- Строение планетарной модели атома Томсона: плюсы и минусы
- Модель атома Томпсона — что из себя представляет
- Предыстория открытия, чем отличалась от модели Резерфорда
- Как описывал атом Томпсон, почему модель назвали «Пудинг с изюмом»
- Плюсы и минусы теории
- Дилемма несоответствия, дальнейшее развитие
- Атомная модель Томсона
- оглавление
- Возникновение
- строительство
- Проблемы и доработки
- Модель атома Томсона
- Содержание
- Описание модели
- Опровержение модели Томсона
Строение планетарной модели атома Томсона: плюсы и минусы
Модель атома Томпсона — что из себя представляет
Модель атома Томпсона является одной из ранних моделей, описывающей строение атома, которая в дальнейшем была признана несостоятельной.
Рассматриваемая модель атома была представлена в 1904 году Д.Д. Томпсоном. Открытию предшествовало обнаружение электронов, а после формулировки гипотезы было обнаружено атомное ядро.
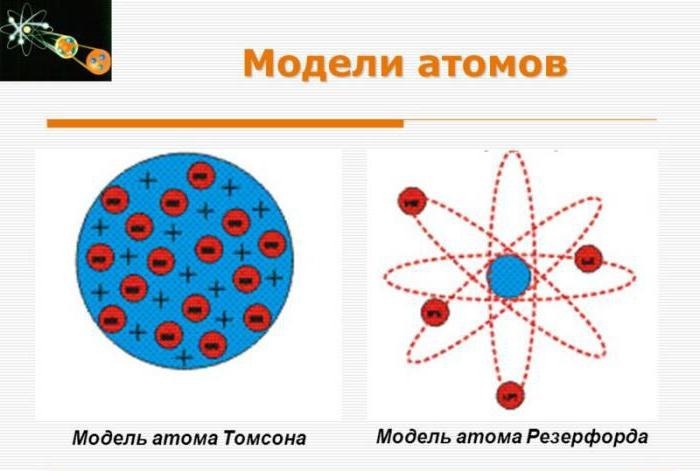
Томпсон выдвинул предположение о том, что атом является равномерно распределенным по всему объему зарядом со знаком плюс. Положительно заряженное «облако» содержит внутри небольшие электроны с отрицательным зарядом, расположение которых определено случайно.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Подобная модель напоминает пудинг с изюмом. Общий заряд атома нейтрален, что обусловлено равенством по модулю суммарного заряда электронов и заряда «облака». Данную модель нередко называют «пудинговой моделью атома».
Предыстория открытия, чем отличалась от модели Резерфорда
В физике 1897 год отмечен знаменательным событием. В это время Джозефом Джоном Томпсоном были открыты электроны. Таким образом, ученому удалось экспериментальным путем подтвердить гипотезу о том, что атом – не «монолитная» частица. Вместе с тем отсутствовало точное представление о характере элементарных частиц.
В результате серии опытов был определен отрицательный заряд электронов. При этом имелась информация о нейтральном заряде атомов. Томпсон выдвинул предположение о наличии некого источника положительного заряда в атоме, что позволяет компенсировать отрицательный заряд электронов. Английским физиком было выдвинуто несколько вероятных механизмов взаимодействия частиц, находящихся внутри атома:
- электрон с отрицательным зарядом присоединяется к частице с положительным зарядом и перемещается вместе с ней;
- электроны совершают вращательные движения вокруг центральной области положительного заряда, который характеризуется такой же величиной, что и все электроны;
- электроны занимают область пространства, являющуюся самостоятельным однородным положительным зарядом.
Ученый остановился на третьем варианте, который казался ему наиболее вероятным, отражающим структуру атомов. Публикация модели атома Томпсона состоялась в 1904 году в мартовском выпуске издания Philosophical Magazine. Журнал пользовался авторитетом в Британии.
Мнение автора заключалось в том, что атомы элементов включают в себя определенное количество отрицательно наэлектризованных корпускул или электронов, которые заключены в сферу равномерной положительной электризации. Тем самым, ученый отказался от предшествующей своей теории о «туманном атоме», согласно которой частицы состояли из нематериальных вихрей.
Научное сообщество проявило большой интерес к публикации Томпсона. Однако гипотеза столкнулась с критикой со стороны многих авторитетных физиков по причине отсутствия прочных доказательств. С другой стороны, рассматриваемая модель атома полностью отвечала представлениям и результатам экспериментов, которые были известны в то время.
Только в 1911 году была представлена более точная модель атома Резерфорда. Отличие от модели Томпсона заключается в том, что, согласно представлениям Резерфорда, положительный заряд расположен в малой области атома, а компенсирующие электроны окружают его. К такому утверждению ученый пришел в результате экспериментов по бомбардировке атомов. В дальнейшем данная модель рассматривалась в качестве планетарной модели атома по Резерфорду.
Как описывал атом Томпсон, почему модель назвали «Пудинг с изюмом»
Томпсон был известен, как проницательный и практичный ученый. Основываясь на известных экспериментальных данных, он выдвинул гипотезу об атомной модели. Предположение о том, что объем заряда положительный, является отражением научного подхода Томпсона к открытию, которое стало руководством к действию для дальнейших экспериментов.
Исходя из теории, стабилизация орбит электронов внутри атомной модели Томпсона объясняется воздействием возрастающей силы притяжения на электрон, удаляющийся от центра положительно заряженной сферы или облака. Данное воздействие способствует возвращению электрона, что обусловлено законом Гаусса, подтверждающим более высокую концентрацию положительного заряда во внутренней области сферы.
Рассматриваемая модель предполагает свободное вращение электронов по кольцам, дополнительно стабилизированным, благодаря взаимодействию электронов между собой. С помощью спектроскопических значений объяснялись энергетические различия между отдельными кольцевыми орбитами.
По представлениям тех времен, расположение электронов в сфере с положительным зарядом напоминало изюм в пироге или фруктовые кусочки в сливовом пудинге. В связи с этим концепция приобрела название «пудинговой» модели атома.
Плюсы и минусы теории
Модель Томпсона является объяснением излучения атомов. Однако весь комплекс эмпирических данных по спектрам атома не был подтвержден в этой модели. Формулы определенных химических элементов описали их спектры, но противоречили рассматриваемой модели. Таким образом, с помощью модели Томпсона не получилось объяснить дискретный характер, которым обладают спектры атомов.
Проблема также заключалась в описании устойчивости атома. Представленная модель не могла охарактеризовать рентгеновское и гамма-излучения, которые испускают атомы. Кроме того, отсутствовали пояснения относительно определения размеров атома. Модель противоречила опытам, направленных на изучение того, как распределяется положительный заряд в атоме. Спустя некоторое время после создания модель Томсона признали ошибочной.
В настоящее время рассматриваемая модель имеет историческое значение и, несмотря на несостоятельность, является важным элементом в цепочке развития научных знаний о строении вещества. В качестве еще одного достоинства модели атома Томпсона можно отметить ее простоту. Благодаря этому преимуществу, гипотезу удалось опровергнуть и продвигать науку дальше.
Дилемма несоответствия, дальнейшее развитие
С увеличением объема экспериментальных данных научное сообщество убеждалось в том, что сущность модели атома Томпсона не соответствовала действительности. Попытки ученого усовершенствовать выдвинутую гипотезу не увенчались успехом. Томпсону не удалось объяснить некоторые из ключевых спектральных линий, которые были выявлены опытным путем при исследовании состава нескольких элементов.
В 1909 году Ганс Гейгер и Эрнест Марсден под кураторством профессора Эрнеста Резерфорда поставили опыты над тонким золотым листом. Схема эксперимента заключалась в рассеивании альфа-частиц на фольге из золота. Полученные данные не оправдали ожидания. В 1911 году Резерфорд по итогу длительных размышлений представил миру собственную концепцию, которая затем получила название «модель атома Резерфорда».
Ученый предположил, что в центральной области атомов золота находится очень маленькое ядро, обладающее мощным положительным зарядом, что позволяет удержать порядка ста электронов.
Сразу после публикации гипотезы Резерфорда было выдвинуто предположение ученым Антониусом Ван ден Бруком о равенстве атомного номера элемента общему количеству единиц заряда, которые присутствуют в его ядре. В 1913 году Генри Мозли предоставил нужную информацию, доказывающую теорию Ван ден Брука. Было установлено соответствие эффективного ядерного заряда атомному номеру.
Исследование легло в основу характеристики полуклассической модели атомов, созданной Нильсом Бором в 1913 году. Данная модель напоминает то, как взаимодействуют Солнце и планеты в Солнечной системе, но при наличии квантовых ограничений.
Благодаря модели атома Томпсона, ядерная физика получила стремительное развитие. Концепцию «сливового пудинга» с одним электроном использовал физик Артур Эрих Хаас в 1910 году, чтобы оценить численное значение постоянной Планка и определить боровский радиус атомов водорода.
Хаас опубликовал работу на три года раньше, чем были представлены выводы Нильса Бора. Важно заметить, что боровская модель обеспечивает достаточно точные прогнозы для атомных и ионных систем, имеющих один эффективный электрон. С помощью теории «пудинга» можно рассчитать оптимальное распределение идентичных точечных зарядов на единичной сфере, которую называют проблемой Томпсона.
Физическая система, отраженная в проблеме Томпсона, представляет собой частный случай одной из восемнадцати математических задач без решения, которые предложил математик Стив Смейл — «распределение точек на двумерной сфере». Проблема Томпсона – это естественное следствие модели «пучкового пудинга» в отсутствие равномерного положительного фонового заряда.
Электростатическое взаимодействие электронов, которые ограничены с помощью сферических квантовых точек, идентично их обработке в атомной модели Томпсона. Классическая задача подразумевает моделирование квантовой точки как простой диэлектрической сферы со свободными или избыточными электронами, а не однородной сферы с положительным зарядом, которая описана в модели «пучкового пудинга».
Атомная модель Томсона
Модель атома Томсона — это модель атома , к которому расположен атом с равномерно распределенной положительно заряженной массой , в котором движутся отрицательно заряженные электроны . Эта модель была разработана Джозефом Джоном Томсоном в 1903 году . Из-за предполагаемого расположения электронов в массе, сравнимого с изюмом в пироге, он также известен как модель сливового пудинга или торта из изюма . В основном состоянии электроны распределены таким образом, что их потенциальная энергия минимальна. При возбуждении они начинают вибрировать.
оглавление
Возникновение
В 1897 году Джозеф Джон Томсон смог доказать, что катодные лучи состоят из заряженных частиц, электронов. Значительно улучшенный вакуум позволил ему определить отношение заряда к массе . Томсон подозревал, что электроны уже присутствовали в атомах катода , и в 1903 году он создал первую модель атома, которая приписывала атомам внутреннюю структуру.
строительство
В исходной модели Томсона только электроны отвечали за массу соответствующего атома. Таким образом, в атоме водорода должно быть более 1800 электронов. С другой стороны, он предположил, что столь же большое количество положительного заряда, которое также присутствует, не имеет массы. Положительный заряд заполнял весь объем атома и был — за исключением электронов — непроницаемым. Хотя Томсон знал, что построенный таким образом атом не может быть стабильным, он смог количественно объяснить нормальный эффект Зеемана .
Проблемы и доработки
Эксперименты с рентгеновскими лучами показали Томсону, начиная с 1906 года, что количество электронов должно быть значительно меньше, чем он предсказывал. Их количество в атоме может быть только примерно равным массовому числу атома.
Один электрон в атоме водорода при возбуждении излучает гармонические колебания через центр атома и тем самым излучает свет . Однако, в отличие от экспериментального наблюдения, здесь допускается только одна спектральная линия .
Эксперимент Резерфорда рассеяния (1909), осуществляется Hans Geiger , Эрнест Marsden и Эрнест Rutherford , показал , что положительный заряд объединяются в атомном ядре и составляет большую часть атомной массы. С помощью этих знаний модель Томсона была усовершенствована в 1911 году и стала атомной моделью Резерфорда .
Модель атома Томсона
Модель Томсона (иначе называемая «пудинговая модель атома») — модель атома, предложенная в 1904 году Джозефом Джоном Томсоном. Открыв в 1897 году электрон, Томсон предположил, что «корпускулы»(так Томсон называл электроны, хотя ещё в 1894 году Дж. Дж. Стоуни предложил называть «атомы электричества» электронами [1] ) являются составными частями атома и решил создать модель атома, отражающую это предположение.
Содержание
Описание модели
С точки зрения Томсона:
…атомы элементов состоят из нескольких отрицательно заряженных корпускул, заключённых в сферу, имеющую однородно распределённый положительный электрический заряд… [2]
Атом по Томсону состоит из электронов, помещённых в положительно заряженный «суп», компенсирующий отрицательные заряды электронов, подобно отрицательно заряженным «изюминкам» в положительно заряженном «пудинге». Электроны, как предполагалось, были распределены по всему атому. Было несколько вариантов возможного расположения электронов внутри атома, в частности вращающиеся кольца электронов. В некоторых вариантах модели вместо «супа» предлагалось «облако» положительного заряда.
Согласно этой модели, электроны могли свободно вращаться в капле или облаке такой положительно заряженной субстанции. Их орбиты стабилизировались тем, что, при удалении электрона от центра положительно заряженного облака, он испытывал увеличение силы притяжения, возвращающей его обратно, поскольку внутри его орбиты было больше вещества противоположного заряда, чем снаружи (по закону Гаусса). В модели Томсона электроны могли свободно вращаться по кольцам, которые стабилизировались взаимодействиями между электронами, а спектры объясняли энергетические различия между различными кольцевыми орбитами.
Статья Томсона была опубликована в марте 1904 года в Философском журнале (Philosophical Magazine), ведущем британском научном журнале того времени. Томсон позднее пытался объяснить с помощью своей модели яркие спектральные линии некоторых элементов, но не особо в этом преуспел.
Тем не менее, модель Томсона (также как подобная модель сатурнианских колец для электронов атомов, которую выдвинул тоже в 1904 году Нагаока, по аналогии с моделью колец Сатурна Джеймса Клерка Максвелла) стала ранним предвестником более поздней и более успешной модели Бора, представляющей атом как подобие Солнечной системы.
Опровержение модели Томсона
Модель атома Томсона 1904 года была опровергнута в эксперименте по рассеянию альфа-части на золотой фольге в 1909 году, который был проанализирован Эрнестом Резерфордом в 1911 году [3] [4] , предположившим, что в атоме есть очень малое ядро, содержащее очень большой положительный заряд (в случае золота, достаточный, чтобы компенсировать заряд около 100 электронов), что привело к созданию планетарной модели атома Резерфорда. Хотя атомный номер золота равен 79, сразу же после появления статьи Резерфорда в 1911 году Антониус Ван ден Брук сделал интуитивное предположение, что атомный номер и является зарядом ядра. Для решения вопроса требовался эксперимент. В 1913 году Генри Мозли экспериментально показал (см. Закон Мозли), что эффективный заряд ядра очень близок к атомному номеру (разность, обнаруженная Мозли, была не больше единицы), причём Мозли ссылался только на работы Ван ден Брука и Резерфорда. Эта работа в итоге привела к созданию в том же году модели атома Бора, похожей на Солнечную систему (но с квантовыми ограничениями), в которой ядро, имеющее положительный заряд, равный атомному номеру, окружено равным числом электронов на орбитальных слоях.